Скритата връзка между черният дроб, жлъчният мехур и хроничните чревни проблеми
- Janny Fant, MNBP

- 14.08.2025 г.
- време за четене: 15 мин.
Актуализирано: 25.11.2025 г.
Човешкият организъм разполага със сложна система от органи, които работят в тясно взаимодействие помежду си. Особено силна е връзката между храносмилателната система и черния дроб – най-голямата храносмилателна жлеза. Черният дроб и жлъчният мехур формират функционална ос, която регулира храносмилането чрез продукцията и секрецията на жлъчка. От своя страна, състоянието на червата и тяхната микрофлора влияят обратно върху чернодробната функция чрез порталното кръвообращение. При хронични чревни симптоми (газове, подуване, диария, коремна болка и др.) все по-често се обсъжда хипотезата, че първопричината може да не е първично чревно заболяване, а дисфункция в черния дроб или жлъчната система.
Оста черен дроб – жлъчен мехур е централен регулатор на храносмилането
Черният дроб и жлъчният мехур са ключов двуединен орган за храносмилането. Черният дроб непрекъснато произвежда жлъчка – около 0,8–1 литър дневно – и я отделя чрез жлъчните каналчета. Жлъчният мехур, разположен непосредствено под черния дроб, служи за съхранение и концентриране на тази жлъчка и при нахранване я изтласква в тънките черва (дванадесетопръстника). Тази координирана ос черен дроб–жлъчен мехур е незаменима за храносмилателния процес – макар формално да се водят „допълнителни“ органи, техните функции са жизненоважни за усвояването на хранителните вещества. Жлъчката емулгира мазнините в храната, което позволява действието на панкреасните липази и абсорбцията на мастноразтворими витамини (A, D, E, K). Без достатъчно жлъчка, мазнините не се разграждат и възникват стеаторея (мастни диарии) и дефицит на витамини.
Регулацията на отделянето на жлъчка се осъществява рефлекторно и хормонално. При постъпване на храна в дванадесетопръстника, особено на мазнини и аминокиселини, се отделя хормонът холецистокинин (CCK), който предизвиква контракция на жлъчния мехур и релаксация на сфинктера на Оди – така жлъчката навлиза в червата в най-подходящия момент. В същото време черният дроб непрестанно отделя жлъчен сок, който в интервалите между храненията се складира в мехура. Ентерохепаталната циркулация осигурява ефективното рециклиране на жлъчните соли – около 95% от жлъчните киселини, отделени в червото, се резорбират обратно в крайния отдел на тънките черва (илеума) и по порталната вена се връщат в черния дроб. Този цикъл позволява малкото количество жлъчни киселини в организма (приблизително 4–6 г общо количество) да се използва многократно при всяко хранене. Черният дроб чувства колко жлъчни киселини се връщат по порталния кръвоток и съответно регулира синтеза на нови – класически пример за чернодробно-чревна регулация. Ако, например, жлъчните киселини не се резорбират добре (поради заболяване на илеума или ускорен транзит), черният дроб ще произвежда повече жлъчка в опит да компенсира загубите.
Оста черен дроб – жлъчен мехур функционира като централен регулатор на храносмилането и пазител на вътрешната среда. Правилната функция на тази ос гарантира ефективно разграждане и всмукване на хранителните вещества, неутрализация на потенциални патогени в храната, както и обезвреждане на токсини преди да достигнат до останалите органи. Нарушаването на тази ос – било то поради чернодробна болест или патология на жлъчните пътища – неминуемо се отразява на храносмилането и върху здравето на червата.
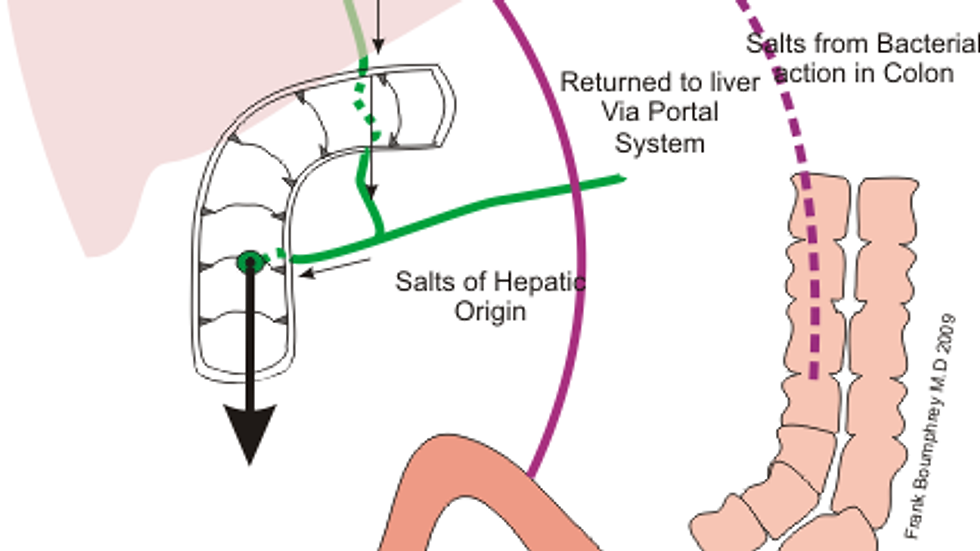
Първичните жлъчни киселини (холева – СА, и хенодезоксихолева киселина – CDCA) се синтезират в черния дроб от холестерол. Те се конюгират с аминокиселини (глицин или таурин) и се секретират в жлъчката, която чрез жлъчния мехур достига до тънките черва след нахранване. В червата чревната микробиота деконюгира първичните киселини (отделяйки глицина/таурина) и чрез серии от реакции ги превръща във вторични жлъчни киселини като дезоксихолева (DCA) и литохолева киселина (LCA). Част от жлъчните киселини се изхвърлят с фецеса, но ~95% се абсорбират обратно в илеума и през порталната вена се връщат в черния дроб (ентерохепатална циркулация). Там жлъчните киселини активират ядрения рецептор FXR, което потиска по-нататъшния им синтез в хепатоцитите. Паралелно, в илеума жлъчните киселини стимулират FXR да индуцира хормона FGF19, който по кръвен път достига черния дроб и също потиска ензимите за жлъчна синтеза – фин механизъм за поддържане на хомеостаза на жлъчните киселини. Обратно, жлъчните киселини влияят върху чревната среда: директно – чрез детергентните си (антимикробни) свойства, и индиректно – чрез модулиране на секрецията на антимикробни пептиди и имунни отговори в червата. В тази двупосочна ос (черен дроб ↔ черва) се крие ключът към разбирането на много състояния.
Чернодробна дисфункция и влиянието ѝ върху състава и регулацията на жлъчните киселини
Здравият черен дроб поддържа деликатен баланс в синтеза, състава и циркулацията на жлъчните киселини (ЖК). При чернодробна дисфункция – например възпаление (хепатит), омазняване (стеатоза), фиброза/цироза или холестаза (нарушено отделяне на жлъчка) – този баланс се нарушава. Черният дроб може да започне да синтезира по-малко жлъчни киселини, а отделянето им в червото да намалее поради увреда на хепатоцитите или запушване на каналчетата. В резултат, общото количество на жлъчни киселини намалява, а пропорциите между различните ЖК се променят. Клинично това се наблюдава при напредналите чернодробни заболявания: повишени серумни нива на жлъчни киселини (поради „изтичане“ в кръвта при холестаза) и едновременно дефицит на жлъчка в червата, водещ до малабсорбция на мазнини. Например пациентите с първична билиарна цироза или обструктивна жълтеница често страдат от стеаторея и дефицит на витамини, именно защото жлъчните киселини не достигат до червата в достатъчна концентрация.
В условия на чернодробна цироза настъпват и по-фини изменения: нарушава се ентерохепаталната регулация на жлъчните киселини. В здраво състояние черният дроб синтезира две основни първични ЖК – холева (СА) и хенодезоксихолева (CDCA) – като контролира съотношението им чрез ензима CYP8B1 (определящ пропорцията холева:хенодезоксихолева). При увреден черен дроб тази прецизна регулация може да се разстрои. Освен това, болният черен дроб често не успява да конюгира оптимално ЖК с глицин/таурин, което води до повече неконюгирани киселини, които са по-токсични за тъканите. Изследвания показват, че при цироза не само намалява общото количество ЖК, но и съставът им се измества – например повишават се относителните нива на някои вторични ЖК (като литохолевата), които обикновено черният дроб ефективно изхвърля. Повишаването на жлъчните киселини в кръвта корелира с усложнения като чернодробна енцефалопатия при цироза, докато концентрацията им в чревния лумен спада, особено при напреднала чернодробна недостатъчност.
Нарушената чернодробна функция засяга и сигналните пътища, с които жлъчните киселини се саморегулират. ЖК са не само храносмилателни детергенти, но и сигнални молекули, които чрез ядрения рецептор FXR (фърнезоиден Х-рецептор) в черния дроб и червата инициират хормонални каскади (напр. отделянето на FGF19 от тънките черва) с цел да потиснат свръхпроизводството на жлъчка. При чернодробни заболявания, особено холестатични, FXR-сигнализацията се компрометира от натрупването на прекомерни количества токсични ЖК в чернодробната тъкан. Това може да доведе до порочен кръг – от една страна черният дроб вече е увреден и не секретира нормално жлъчка, от друга страна потискането на синтезата чрез сигнални пътища (поради задържаните киселини) още повече намалява новообразуването на ЖК. Така червата страдат от хроничен дефицит на жлъчка, въпреки че в кръвта на пациента нивата могат да са повишени (причинявайки системни ефекти като сърбеж и др.).
Последиците от променения състав и намаленото количество на жлъчни киселини са значими: чревната микробиота се променя и често възниква дисбаланс (дисбиоза). Причината е, че жлъчните киселини нормално действат като **екологичен регулатор** в червата – те потискат свръхрастежа на бактерии и поддържат определен състав на микробното общество. При цироза и хронични чернодробни заболявания, изследванията показват разстройство на чревния микробиоценоз, свързано именно с изменените жлъчни киселини. С напредване на чернодробната декомпенсация, общото количество на жлъчни киселини прогресивно намалява и това води до спад в „добрите“ (полезни) бактерии и нарастване на патогенни видове в червата. С други думи, чернодробната дисфункция разстройва хомеостазата на жлъчните киселини, а това вторично причинява дисбиоза. Получава се класическа ос „болен черен дроб → болна жлъчка → болни черва“, която обяснява защо много пациенти с хронични чернодробни заболявания страдат и от хронични чревни оплаквания.
Ролята на жлъчните соли за поддържане на здравословна чревна среда. SIBO
Жлъчните соли/киселини изпълняват в червата функции, далеч надхвърлящи простото участие в смилането на мазнини. Те са важен фактор за чревната среда и микробиота. Първо, жлъчните киселини действат антимикробно – те разрушават бактериалните мембрани и затрудняват растежа на редица бактерии в тънките черва. Това е причината обикновено тънкото черво да има сравнително нисък бактериален контент в сравнение с дебелото – жлъчката държи бактериите под контрол. Ако концентрацията на жлъчни соли в лумена спадне (например при недостатъчна секреция), този контрол отслабва и микроорганизмите могат да свръхрастат (SIBO). Научни публикации потвърждават, че жлъчните киселини „оформят“ микробния състав в червата чрез директното си антимикробно действие и чрез модулиране на сигналните пътища на гостоприемника, поддържащи чревната хомеостаза. С други думи, жлъчката служи като **естествен дезинфектант** в тънкото черво, предотвратявайки прекомерната колонизация с бактерии, които биха ферментирали храната преждевременно или биха предизвикали възпаление.
Освен това, жлъчните киселини насърчават нормалната перисталтика на червата. Наличието на жлъчка в илеума стимулира определени клетъчни рецептори (напр. TGR5 и FXR в ентероендокринните клетки), което води до отделяне на чревни хормони като GLP-1 и модулиране на перисталтиката. Това е адаптивен механизъм: след нахранване жлъчката не само емулгира мазнините, но и подпомага придвижването на чревното съдържимо напред. Ако жлъчен сок липсва, чревният пасаж може да се забави, което също предразполага към бактериален свръхрастеж (защото хранителният субстрат престоява по-дълго и позволява размножаването на микробите). В този контекст, жлъчните соли са фактор и за чревната пропулсия.
Жлъчните киселини имат и имуно-модулиращо действие върху чревната лигавица. Чрез взаимодействието си с ядрени и мембранни рецептори в чревния епител, те регулират отделянето на антимикробни пептиди (като дефензини) и поддържат целостта на мукозната бариера. По този начин достатъчните нива на жлъчни киселини допринасят за стегнати междуклетъчни връзки в епитела и предпазват от повишена пропускливост на червата. Ако жлъчната секреция е хронично занижена, защитният слузен слой и епителната бариера на тънките черва може да отслабнат, откривайки път на бактерии и токсини към стената на червото.
Не на последно място, чревната микробиота и жлъчните киселини съжителстват във взаимовръзка – бактериите в дебелото черво модифицират жлъчните киселини (превръщат ги във вторични метаболити), а тези метаболити от своя страна могат да имат различно въздействие върху други бактерии. Например, някои бактерии (род Lactobacillus, Bifidobacterium) могат да разграждат жлъчни соли и да използват освободените аминокиселини, докато други патогени трудно оцеляват в присъствието на високи концентрации на жлъчка. Така балансът на микробиотата до голяма степен зависи от наличието и състава на жлъчните киселини в чревния лумен. Ако този състав се промени внезапно (например при резекция на илеума или прием на жлъчегонни/жлъчко-свързващи лекарства), микробиотата също се пренарежда.
Влияние на чернодробните токсини (ксенобиотици, тежки метали, лекарства) върху жлъчната секреция и връзката им с дисбиоза/SIBO
Черният дроб е главният „пречиствател“ на организма, но тази негова функция го излага на редица ксенобиотици – чужди за тялото химически вещества, включително лекарства, алкохол, замърсители и тежки метали. Много от тези субстанции се натрупват в черния дроб поради богатото кръвоснабдяване и функцията му да ги улавя от порталната кръв. Черният дроб се стреми да ги обезвреди чрез своя ензимен апарат и често ги екскретира с жлъчката – т.е. отделя ги в жлъчния сок, за да бъдат изхвърлени през червата. Това означава, че жлъчната система е един от основните пътища за елиминиране на токсини. Например, тежките метали като олово, кадмий, живак частично се отделят с жлъчката; редица лекарства и техни метаболити – също (вкл. някои антибиотици, противогъбични препарати, контрастни вещества и др.).
Проблемът е, че някои токсини могат да повредят самия механизъм на жлъчна секреция. Тежките метали например имат склонност да предизвикват оксидативен стрес и възпаление в черния дроб. Кадмият (Cd) е показан в експерименти с животни да причинява холестаза и натрупване на токсични жлъчни киселини в черния дроб, увреждайки хепатоцитите. Оловото (Pb) и живакът (Hg) също се асоциират с чернодробни увреждания, включително нарушена функция на жлъчните каналчета. Дори и есенциални микроелементи като мед и желязо, когато се натрупат в излишък, могат да доведат до холестатични явления и възпаление. Тези ефекти на тежките метали върху черния дроб се отразяват директно върху качеството и количеството на отделяната жлъчка.
Що се отнася до лекарствата, медицината познава редица примери на лекарствено-индуцирана холестаза – състояние, при което потокът на жлъчка се възпрепятства заради токсично действие на медикамент. Такива лекарства са например някои антибиотици (макролиди като еритромицин, цефтриаксон), анаболни стероиди, орални контрацептиви, противогъбични препарати (флуконазол), НСПВС и др. При прием на подобни медикаменти може да се развие картина на холестатичен хепатит – чернодробните ензими са повишени, пациентът пожълтява (заради задържана жлъчка), а чревните симптоми включват тежко разстройство на храносмилането: мазни изпражнения, подуване, склонност към диария. Това не е изненадващо, тъй като блокирането на жлъчния поток означава, че в червата не постъпват жлъчни киселини. Без жлъчка настъпва SIBO (бактериален свръхрастеж) – бактериите не срещат обичайната си химична бариера и се размножават, което води до газове и подуване. Наред с това, неусвоените мазнини дразнят дебелото черво и предизвикват осмотична диария. Така лекарство, повлияващо черния дроб, вторично причинява чревен синдром.
Дори по-слаботоксични на пръв поглед вещества, каквито са някои хранителни консерванти, емулгатори, алкохолът, могат хронично да натоварят черния дроб и да доведат до „забавена“ жлъчка. Пример е редовната консумация на алкохол – тя стимулира образуването на мастен черен дроб (стеатоза) и възпаление, което може да наруши секрецията на жлъчка. Нещо повече – алкохолът пряко променя състава на чревната микрофлора и увеличава транслокацията на ендотоксини, което допълнително уврежда черния дроб.
Тежките метали и ксенобиотиците могат също да изменят състава на жлъчката – например относителното съдържание на фосфолипиди и холестерол спрямо жлъчните соли. Това има значение, защото дисбалансът между холестерол и жлъчни соли може да доведе до утайки и камъни в жлъчния мехур. Някои токсини понижават секрецията на фосфатидилхолин (основен фосфолипид в жлъчката), което прави жлъчния сок по-„литогенен“ (склонен към образуване на холестеролови камъни). Образуването на камъни пък механично затруднява изтичането на жлъчка, създавайки хронична субклинична холестаза. Пациенти с жлъчни камъни често изпитват диспептични оплаквания и подут корем дори без наличието на остър пристъп – вероятно поради свързан микробен дисбаланс в червата, обусловен от неравномерния поток на жлъчка. Изследване от 2023 г. установява, че заболяванията на жлъчния мехур (напр. полипи на жлъчния мехур) се асоциират с 5 пъти по-висока честота на SIBO, като се предполага механизмът да е нарушена хомеостаза на жлъчните киселини и отслабен антимикробен ефект в тънките черва. Интересно е, че е възможна и обратна връзка – самият SIBO да допринася за заболявания на жлъчния мехур (напр. чрез промяна в състава на рециклираните жлъчни киселини, които влияят на жлъчната стена).
Дисбиозата и SIBO като последици от чернодробни токсини
Когато черният дроб е хронично натоварен с токсини и медикаменти, често има скрита холестаза – леко, но постоянно намален жлъчен поток. Това е достатъчно, за да се наруши антимикробната защита на тънките черва и да се стигне до дисбиоза. Освен количествения дефицит на жлъчка, самите токсини могат да попаднат с жлъчния сок в червата и директно да повлияят микрофлората там. Например, антибиотиците се екскретират частично в жлъчката и могат да причинят дисбаланс, убивайки коменсалните бактери и селекционирайки по-устойчиви щамове. Някои химикали пък могат да стимулират растежа на определени патогенни бактерии или гъбички, ако действат като хранителен субстрат за тях.
Околна среда и дисбиоза
Модерни изследвания все по-често отчитат, че хроничното излагане на ниски дози замърсители – пестициди, органични разтворители, микропластмаси – може да промени състава на чревната микробиота (макар механизмите да не са напълно ясни). Чревната микробиота е първата линия на контакт с перорално приети токсини и реагира съответно – чрез промяна в видовия състав и метаболитна активност. Така една токсична среда (външна или вътрешна) може да доведе до синдром на раздразненото черво, поддържан не толкова от първична чревна патология, колкото от чернодробно-жлъчни фактори.
Нарушена жлъчна секреция като предпоставка за чревно възпаление, „пропускливи черва“ и системни възпалителни реакции
Когато жлъчната секреция е нарушена за дълго време, последиците върху чревната стена и имунната система са дълбоки. Хроничният дефицит на жлъчни киселини в червата води до свръхрастеж на бактерии и дисбиоза, което само по себе си предизвиква локално възпаление. Патогенните или прекомерно размножени коменсални бактерии отделят ензими и токсини, които дразнят чревната лигавица. Например, при SIBO бактериите ферментират застоялата храна и образуват късоверижни мастни киселини, газове и други метаболити, които могат да причинят подуване, болка и възпалителна реакция в тънките черва. Бактериите също така деконюгират жлъчните киселини (разграждат ги до вторични форми). Някои от тези вторични жлъчни киселини – ако се натрупат необичайно много – са дразнещи и токсични за чревната лигавица (напр. литохолевата киселина във високи концентрации може да увреди клетките). Така порочният кръг се затваря: липсата на жлъчка → бактериален свръхрастеж → деконюгация и производство на токсични метаболити → увреда на чревната стена и възпаление.
Едно от сериозните последствия на хроничното чревно възпаление е развитието на повишена чревна пропускливост, известна популярно като „leaky gut“ (пропускливо черво). В нормално състояние клетките на чревния епител са свързани помежду си с плътни връзки (tight junctions), които не позволяват на големи молекули и микробни компоненти да преминат неконтролирано. При възпаление обаче се отделят цитокини и медиатори, които разграждат тези плътни връзки. В резултат бариерната функция на червата отслабва – през епитела започват да проникват ендотоксини, недобре смлени хранителни антигени и дори цели бактерии. Липополизахаридът (LPS) – основен компонент от клетъчната стена на Грам-негативните бактерии – е най-известният ендотоксин. При „пропускливо черво“ LPS масово навлиза в ламина проприя на червата и оттам в кръвообращението (чрез порталната вена). Резултатът е системна имунна активация: LPS се свързва с рецептора TLR4 върху имунните клетки и провокира отделянето на провъзпалителни цитокини като TNF-α, IL-6, които циркулират и могат да причинят увреждания в различни органи.
Системните възпалителни реакции вследствие на ендотоксемията често са тихи и хронични, но допринасят за редица заболявания. Например, смята се, че метаболитният синдром и неалкохолният стеатохепатит (неалкохолна мастна чернодробна болест) са свързани с нискостепенна ендотоксемия – постоянно леко повишени нива на LPS в кръвта, идващи от „пропускливите черва“. Това постоянно дразнене на имунната система води до инсулинова резистентност, системно възпаление на съдове (атеросклероза) и влошаване на чернодробното възпаление. Сходен механизъм се обсъжда и при автоимунни заболявания – бактериални компоненти, преминали в кръвта, могат да кръстосано реактивират имунната система срещу собствени тъкани.
Що се касае до червата локално – повишената пропускливост може да доведе до непоносимост към различни храни, тъй като необичайно големи антигени преминават и сенсибилизират имунната система. Пациенти с „leaky gut“ често описват множество хранителни чувствителности и влошаване на симптомите при разнообразни диети, което затруднява лечението.
Нарушената жлъчна секреция предизвиква и промени в дебелото черво. Когато жлъчните киселини не се абсорбират добре в тънките черва (например при илеална дисфункция или твърде бърз чревен транзит), прекомерно количество от тях попада в дебелото черво. Там те дразнят мукозата и предизвикват секреция на вода и електролити – получава се т.нар. жлъчно-киселинна диария. Това допълнително уврежда чревната лигавица и може да хронифицира възпалението. Обратно, при недостиг на жлъчни киселини (какъвто е случаят, който разглеждаме), дебелото черво пък страда от излишък на несмлени мазнини, които бактериите ферментират до дразнещи съединения. Така или иначе, синдромът на хронично чревно възпаление и пропускливост може да бъде директно следствие от проблем „нагоре по веригата“ – недостатъчна или неправилна жлъчна секреция.
Дисбалансът на чревната флора и въздействието му върху черния дроб чрез порталната вена и ендотоксините (LPS)
Връзката между червата и черния дроб е двупосочна – не само черният дроб влияе на чревната среда, но и състоянието на чревната микробиота рефлектира върху черния дроб. Тази взаимовръзка е известна като „оста черва–черен дроб“ (gut-liver axis). Анатомичната основа за нея е порталната венозна система: цялата венозна кръв от червата (богата както на хранителни вещества, така и на бактериални продукти) се събира в порталната вена, която отива директно в черния дроб. По този начин черният дроб е непрекъснато изложен на влиянието на чревната микробиота.
Ендотоксините, сред които най-известен е LPS (липополизахарид), са ключови посредници на това влияние. В здравословни условия малки количества LPS преминават през червата, но се неутрализират ефективно в черния дроб – купферовите клетки (чернодробните макрофаги) ги улавят и деградират, а хепатоцитите могат да ги модифицират. При дисбиоза и повишена чревна пропускливост (leaky gut), количеството LPS, влизащо по порталната вена, рязко нараства. Черният дроб е принуден да реагира: купферовите клетки се активират силно чрез Toll-подобните рецептори (TLR4) и започват да отделят възпалителни цитокини (TNF-α, IL-1β, IL-6). Това води до вътречернодробно възпаление – т.нар. ендотоксин-индуциран хепатит. Клинично такова състояние се наблюдава при пациенти с алкохолен или неалкохолен стеатохепатит: описва се повишен LPS в кръвта и свръхекспресия на възпалителни гени в черния дроб. Счита се, че ендотоксините са „спусъкът“ за прогресията от проста стеатоза (мастен дроб) към стеатохепатит (мазен дроб с възпаление). Това е потвърдено и експериментално – при животински модели приложението на LPS води до чернодробна инсулинова резистентност, натрупване на мазнини и възпалителни изменения, докато блокирането на LPS или премахването на Грам-негативната флора предотвратява тези промени.
Друг механизъм, по който чревната флора влияе на черния дроб, е чрез метаболитните си продукти. Някои бактерии произвеждат етанол ендогенно (например Klebsiella при дисбиоза може да доведе до т.нар. авто-пивоварен синдром). Дори малки количества хронично произвеждан етанол в червата натоварват черния дроб и могат да допринесат за неалкохолен мастен черен дроб, който наподобява алкохолния. Други бактериални метаболити – триметиламин (TMA) от чревните бактерии (при разграждане на хранителни холин и карнитин) – се транспортират до черния дроб, където се окисляват до TMAO и участват в процесите на атеросклероза и възпаление. Освен това, бактериалната ДНК и компоненти (пептидоглюкан, бактериални екзотоксини) също могат да активират имунните пътища в черния дроб при масивна транслокация.
Възпалителният отговор в черния дроб вследствие на тези микробни сигнали може да прерасне във фиброза. LPS-активираните купферови клетки стимулират звездовидните клетки (Ito клетки) да произвеждат колаген – развива се чернодробна фиброза. Това е един от причините пациенти с чревни възпалителни заболявания или SIBO да имат по-висок риск от чернодробни увреждания. Например, при цироза често се открива SIBO и повишен LPS, което влошава порталната хипертония и води до усложнения като спонтанен бактериален перитонит. От друга страна, лечението на SIBO (напр. с рифаксимин) при циротици подобрява системното им състояние и намалява епизодите на енцефалопатия, което подчертава ролята на чревно-чернодробната ос.
Струва си да се спомене, че черният дроб също влияе обратно върху червата чрез имунни механизми – при чернодробна възпалителна активация той освобождава в кръвта цитокини и остра-фазови протеини, които достигат чревната стена и могат да променят нейната пропускливост и имунни свойства. Така се оформя въртяща се спирала: дисбиоза → LPS → чернодробно възпаление → системни възпалителни фактори → още повече чревна пропускливост → засилена дисбиоза, и т.н. Това обяснява защо при много хронични състояния (напр. затлъстяване, диабет, чернодробни болести) се наблюдават едновременно чревни проблеми и чернодробни изменения.
Разпознаването на тази ос е ключово за терапията на редица заболявания. Например, при пациенти с неалкохолна мастна чернодробна болест интервенции, насочени към червата – пробиотици, пребиотици, синбиотици, фекална трансплантация – показват обещаващи резултати в намаляване на чернодробните ензими и възпаление. Обратно, урсодезоксихолевата киселина (Urso) – медикамент, който подобрява жлъчния поток – има благоприятен ефект и върху чревната флора, намалявайки SIBO при пациенти с първичен билиарен холангит, например. Всичко това сочи, че медицината трябва да разглежда черния дроб и червата като единна функционална система.
Източници:
OpenStax Anatomy & Physiology – 23.6: Черен дроб, панкреас и жлъчен мехур (аксесорни храносмилателни органи). *Роля на черния дроб и жлъчния мехур в *храносмиланетоopenstax.orgopenstax.org.*
Johns Hopkins Medicine – The Digestive Process: Liver and its Many Functions. *Производство на жлъчка в черния дроб; дефиниция на холестаза и причините ѝ (напр. лекарства)*hopkinsmedicine.orghopkinsmedicine.org.*
Frontiers in Pharmacology, 2023 – Feng Zhu et al., The regulatory role of bile acid–microbiota in liver cirrhosis. *Чернодробна цироза, промени в жлъчните киселини и чревна дисбиоза; понижен пул на ЖК и дисбаланс на *микробиотатаfrontiersin.orgfrontiersin.org.*
Gut Microbes, 2023 – Anaïs Larabi et al., Bile acids as modulators of gut microbiota. *Жлъчните киселини оформят състава на микробиотата чрез антимикробно действие и хост-сигнализация; промените в пулa ЖК водят до възпаление или *инфекцииpubmed.ncbi.nlm.nih.gov.*
Int. Journal of General Medicine, 2023 – Dong et al., SIBO in patients with gallbladder polyps. *Връзка между дисфункция на жлъчния мехур и SIBO; нарушена хомеостаза на жлъчните киселини и отслабен антимикробен ефект като механизъм на *SIBOresearchgate.net.*
Acta Biochimica Polonica, 2014 – Lisowska et al., SIBO in familial cholestasis. *Честа поява на SIBO (35%) при пациенти с фамилна холестаза (PFIC); SIBO води до токсични метаболити, увреждащи лигавицата и нарушаващи *всмукванетоfrontierspartnerships.orgfrontierspartnerships.org.*
Frontiers in Nutrition, 2024 – Zhu et al., Toxic and essential metals & gut microbiota. *Излагането на тежки метали (As, Pb, Cd, Hg) дисруптира чревната микробиота и влияе на метаболизма ѝ, допринасяйки за метаболитни и други *нарушенияfrontiersin.org.*
Gut Liver (Review), 2022 – Ji et al., Gut-derived LPS and intestinal barrier in fatty liver disease(PMC8926958). *Дисбиоза и нарушена бариера допринасят за NAFLD; LPS е ключов фактор, индуциращ възпалението в черния дроб чрез TLR4; ендотоксемия при NAFLD/ALD*pmc.ncbi.nlm.nih.govpmc.ncbi.nlm.nih.gov.*



Коментари